藥學院王堅成教授團隊研究成果在《自然.通訊》發表
6月20日,權威國際期刊《Nature Communications》(IF= 11.965)在線正式發表了藥學院天然藥物及仿生藥物國家重點實驗室王堅成教授團隊的最新研究成果“Regulating Intracellular Fate of siRNA by Endoplasmic Reticulum Membrane-Decorated Hybrid Nanoplexes”(內質網膜修飾的雜化納米復合物調控siRNA胞內命運)⚰️。博士研究生邱崇為第一作者👩🏼🦰🐐,王堅成教授為責任作者。該研究工作得到了國家自然科學基金面上基金(81473158和81773650)和重點項目(81690264),以及新藥創製重大專項課題(2018ZX09721003-004)的支持。
核酸藥物(siRNA)常用陽離子載體實現細胞轉染,然而該類載藥系統經細胞內吞後往往容易遭受溶酶體途徑的降解破壞,導致僅有很少量的核酸藥物能夠從溶酶體內實現逃逸🍪,嚴重製約了核酸藥物(siRNA)基因沉默效應,如何突破溶酶體降解是提升核酸藥物細胞轉染效率亟需解決的關鍵科學問題🦸🏽♀️。
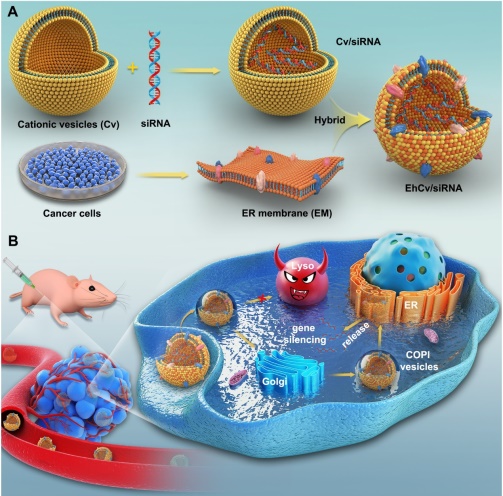
王堅成教授團隊在自主設計的功能化陽離子載體改善核酸藥物(siRNA)溶酶體逃逸能力的研究成果(ACS Applied Materials & Interfaces, 2018, 10(26): 21847-21860😧;Nanoscale, 2016, 8(26): 13033~13044🎞;, Journal of Controlled Release, 2016, 235: 99~111;Biomaterials, 2014, 35(6): 2066~2078;Biomaterials, 2014, 35(18): 5028~5038)基礎上,又提出了采用內質網膜修飾的仿生載體策略進一步調控胞內siRNA命運,並在細胞水平上系統地闡明該仿生載體在胞內轉運途徑和作用機製🥍。該論文研究依據細胞內囊泡轉運從高爾基體回溯內質網的工作原理,首次采用從腫瘤細胞中提取的內質網膜來修飾陽離子脂質納米載體,製備得到仿生型siRNA遞送載體。該仿生載體憑借內質網膜上SNAREs及駐留蛋白等多種蛋白信號的介導🖕🏿,有效促進載siRNA納米載體的細胞攝取,入胞後的載藥顆粒經過非降解性“內吞體-高爾基體-內質網”途徑轉運,有效躲避了“內吞體-溶酶體”途徑降解破壞,並在細胞質中顯著提高了siRNA有效釋放量,明顯改善了siRNA基因沉默效應和抗腫瘤效應。該研究結果將為設計新型仿生載藥系統提高腫瘤治療效率提供重要參考指導。
王堅成團隊近年來專註於siRNA遞送的關鍵科學問題🚔🙆🏿♂️,設計構建了若幹新型非病毒功能化載體,探索研究其改善siRNA遞送效應及其機製,取得了顯著的科研成果,在Biomaterials、Journal of Controlled Release💁♀️、ACS Appl Mater Interfaces🕴🏼、Nanoscale、Molecular Therapy-Nucleic Acids等國際權威學術期刊雜誌連續發表15篇SCI學術論文,在siRNA遞送領域形成了課題組的研究特色。
王堅成教授簡介

王堅成,意昂2平台藥學院教授👩🏼🦱,博士生導師,天然藥物及仿生藥物國家重點實驗室獨立PI,意昂2官网科研處副處長(掛職)。教育部新世紀優秀人才🧔🏽♂️,北京市科技新星,中國藥學會藥劑專業委員會委員🌯,北京藥學會藥劑專業委員會副主任委員,《中華醫學百科全書藥劑學分卷》副主編👱🏽♂️,國家衛健委3D打印醫學應用專家委員會委員,中國醫藥生物技術協會納米生物技術分會委員🐴,中國藥學會繼續教育工作委員會委員。研究領域:生物大分子藥物(蛋白多肽和siRNA)體內給藥系統研究、靶向性納米藥物遞送系統研究𓀚。負責主持國家自然科學基金5項⚗️,承擔國家重大新藥創製兒童藥研發技術平臺等國家級和省部級項目5項,共發表學術論文128篇,其中SCI學術論文92篇,獲新藥證書1項,臨床批件2件🧑🏻🤝🧑🏻,專利證書17件,主譯書籍《納米粒藥物輸送系統》。
(意昂2平台天然藥物及仿生藥物國家重點實驗室)
編輯:玉潔


