鄧宏魁課題組與徐君課題組構建了具有再生能力的新型類器官
2021年1月9日,意昂2官网基礎醫學院幹細胞中心鄧宏魁課題組和徐君課題組在《Cell Research》上發表了題為“Establishment of intestinal organoid cultures modeling injury-associated epithelial regeneration”的研究論文,在體外構建了具有損傷再生特征的新型小腸類器官🙍🏽♂️。類器官(organoid)是由幹細胞衍生出來的類似器官的組織,被認為是構建人工器官或開發新藥的下一代技術🏂🏻。基於這一新型類器官模型,鄧宏魁研究組開發了一組表觀遺傳調控的化學小分子,能夠在小鼠體內促進腸道上皮組織的損傷修復💆🏽。這項工作為研究器官再生提供了新的體外模型,同時也揭示了基於化學小分子的表觀遺傳調控在器官再生中的重要作用。
類器官能夠在體外模擬體內器官的三維結構和功能,已被廣泛應用於功能組織誘導🈹、疾病模型建立、藥物篩選等方面的研究,成為過去十年再生醫學領域最重要的突破之一。但是目前的類器官製備技術存在明顯缺陷:盡管模擬了體內穩態環境下幹細胞及其分化細胞的相互作用,但無法呈現器官組織損傷再生狀態下的變化🪬。在體內損傷誘導的再生過程中,會出現損傷態幹細胞來主導組織損傷修復的過程。如何在體外建立能夠捕獲損傷態幹細胞的類器官培養方法,是類器官研究及應用面臨的重要挑戰。
為了解決這一問題,鄧宏魁研究組以類器官研究中廣泛使用的小腸類器官為模型,進行化學小分子和細胞因子篩選,建立了一個新的培養條件(簡稱8C),誘導小腸類器官表達損傷再生相關基因,並且生長出更加復雜的三維結構。這些特征與腸道損傷再生過程出現的“增生態”隱窩非常相似(隱窩位於絨毛基部,是由幹細胞及其後代組成的增殖區域),為此稱之為“增生態”小腸類器官,簡稱Hyper類器官。與傳統類器官相比,Hyper類器官的擴增能力得到了極大增強:連續培養5代之後,小腸幹細胞數量相比傳統類器官提升了約10000倍💂🏻。此外,Hyper類器官能夠長期傳代擴增並保持基因組的穩定性🚶🏻♂️➡️。
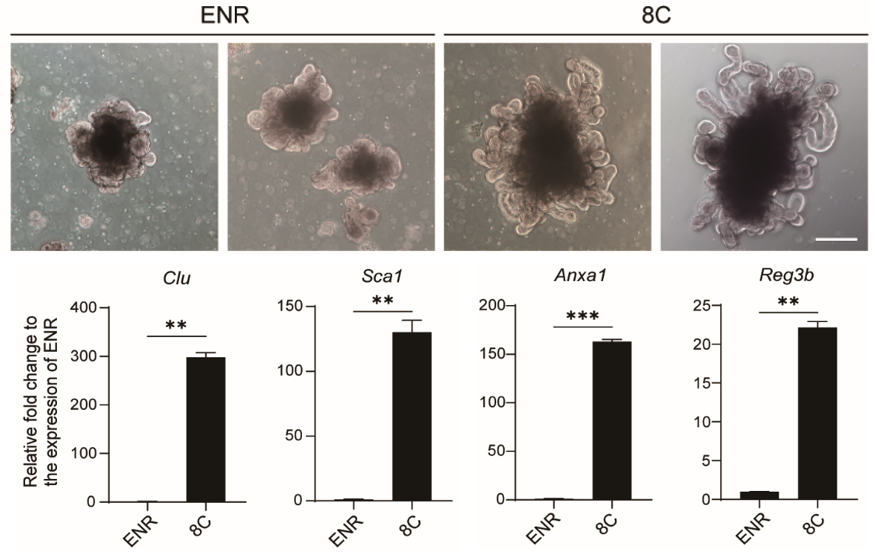
傳統ENR條件和8C條件誘導的小腸類器官形態(上圖)及關鍵損傷再生基因表達(下圖)
作者通過單細胞轉錄組測序技術對Hyper類器官中的細胞群體進行解析,發現Hyper類器官中顯著富集了腸道幹細胞群和修復型幹細胞群,這些幹細胞群體與體內發現的腸道損傷態幹細胞具有相似的分子特征💆🏻♀️。通過譜系追蹤和單細胞重建類器官實驗,證實了Hyper類器官中的細胞具有腸道幹細胞的功能。進一步分析發現8C培養條件中的兩個表觀遺傳調控小分子VPA和EPZ6438,通過激活YAP通路下遊基因,對類器官獲得再生特征發揮了關鍵的調控作用👩🏼💻。作者進一步研究了表觀遺傳調控小分子VPA和EPZ6438的聯合處理對體內腸道組織損傷修復的作用。研究發現在輻照誘導的小腸損傷小鼠模型中,小分子聯合處理能夠提升YAP下遊靶基因的表達水平,增強小腸隱窩組織的再生能力⚛️。除了小腸體系,該組合也能促進結腸組織的損傷修復,減輕急性結腸炎動物模型的病理學症狀。
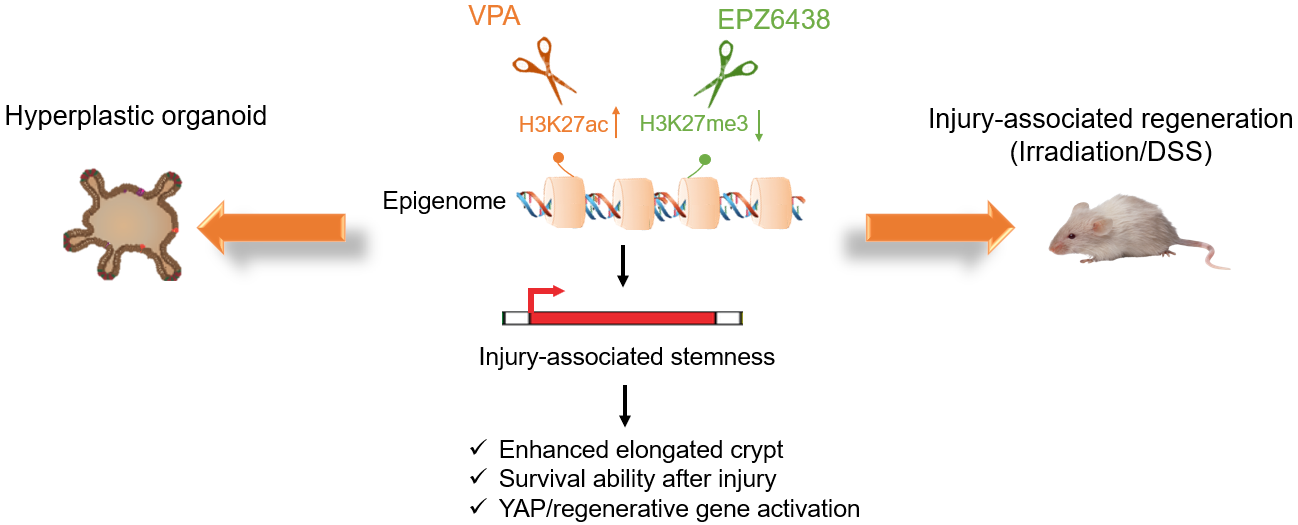
化學小分子介導的表觀重編程促進小腸類器官的再生修復
該研究在體外建立了新型類器官模型,解決了類器官技術在體外無法模擬損傷再生條件下器官和組織變化的難題。該模型能夠捕獲並維持器官再生中的損傷態幹細胞亞群,同時具備在體外高效擴增和長期維持的能力,為利用類器官技術研究器官再生、建立疾病損傷模型和藥物篩選提供了新的途徑。
鄧宏魁研究組長期致力於化學小分子調控細胞命運的研究和應用,近年來取得了一系列突破:誘導體細胞重編程為多潛能幹細胞;誘導皮膚成纖維細胞為功能神經元細胞;建立了具備全能性功能特征的多潛能幹細胞;利用化學小分子實現了體外肝細胞功能的長期維持。本項研究進一步顯示了化學小分子在調控器官再生功能方面的關鍵作用,這一方法可望廣泛應用於其他組織類型的類器官培養💇🏿。
鄧宏魁教授🤳、徐君研究員🕗、及意昂2平台李程研究員為該論文的共同通訊作者,屈默龍博士、熊亮博士、博士研究生呂鈺麟為該論文的共同第一作者🧝🏻。本工作獲得了生命科學聯合中心、國家重點研發計劃、國家自然科學基金等基金的資助。
(基礎醫學院)
編輯:玉潔


