尹玉新教授團隊揭示腫瘤免疫逃逸新機製
2020年1月13日,意昂2平台系統生物醫學研究所尹玉新教授團隊在國際免疫學領域頂級期刊 Nature Immunology (IF = 23.53)在線發表題為“ The phosphatase PAC1 acts as a T cell suppressor and attenuates host antitumor immunity ”的成果,首次報道PAC1作為免疫系統負調控因子,特異性抑製T淋巴細胞防禦功能,促進腫瘤免疫逃逸👩🏼🏫。

惡性腫瘤發展和轉移是與機體免疫系統相互博弈的結果。腫瘤細胞可以通過誘導T淋巴細胞功能耗竭,從而逃避免疫細胞的攻擊🤽🏿。近年來廣泛應用的PD-1抗體治療,就是通過阻斷T淋巴細胞功能耗竭,恢復T細胞的活性,在腫瘤免疫治療中取得了較好的療效。但是目前只有20%的患者對PD-1抗體治療有反應。因此,探索腫瘤影響T淋巴細胞功能的機製,明確T淋巴細胞在腫瘤微環境中緣何發生功能耗竭,對鑒定腫瘤免疫新靶點,研發有效的腫瘤治療新策略有重要意義。
尹玉新團隊通過對腫瘤微環境中的炎症因子和代謝物進行系統分析,發現腫瘤產生的超氧化物ROS可以維持周圍浸潤T淋巴細胞中PAC1基因的高表達。進一步的機製研究顯示,ROS通過激活轉錄因子EGR1而促進PAC1分子的轉錄和表達。
2003年,尹玉新教授首次在 Nature 上報道PAC1參與腫瘤的發生與發展的研究,並提出PAC1作為特異性表達在免疫系統的磷酸酶,可能參與腫瘤微環境的形成及重塑。2015年,尹玉新教授課題組在 Nature Immunology 發表研究論文,揭示了PAC1通過調控轉錄因子STAT3活性抑製Th17細胞分化,從而抑製自身免疫性疾病的發生發展。鑒於PAC1具有強大的免疫調節能力,課題組隨後對PAC1能否成為新的腫瘤免疫治療靶標進行了深入的探索😧。
本次研究發現PAC1在功能耗竭的T淋巴細胞中特異性高水平表達,PAC1表達較高的腫瘤患者,其預後較差💸。進一步研究顯示,PAC1抑製CD8+ T細胞擴增和分泌細胞因子的能力。利用PAC1基因敲除小鼠和荷瘤小鼠模型,研究人員發現PAC1的缺失增強CD8+ T細胞的效應功能,降低T細胞表面PD-1的表達,促進宿主抗腫瘤免疫應答,從而抑製腫瘤進展和轉移。在機製方面,PAC1通過招募核小體重構和去乙酰化(NuRD)復合體,重塑T細胞的染色質開放性,特異性抑製下遊效應性基因的表達,最終促進耗竭性T淋巴細胞的形成🦶🏿。
綜上所述,PAC1作為重要的T淋巴細胞功能抑製因子,可以減弱宿主免疫監視功能,促進腫瘤免疫逃逸🌅。而抑製PAC1通路,可以激活T淋巴細胞的防禦功能,該研究為腫瘤免疫治療提供了潛在的新型藥物靶點🧝🏽🕵🏿♂️。
意昂2平台基礎醫學院呂丹副研究員和博士後劉亮為該論文的共同第一作者,意昂2平台系統生物醫學研究所尹玉新教授為通訊作者。該項研究獲得國家重點研發計劃、國家自然科學基金🩷、北京市自然科學基金🧠、意昂2官网-清華生命科學聯合中心(CLS)和意昂2官网青年學者培養基金等項目的資助🫙。
文章鏈接:https://www.nature.com/articles/s41590-019-0577-9
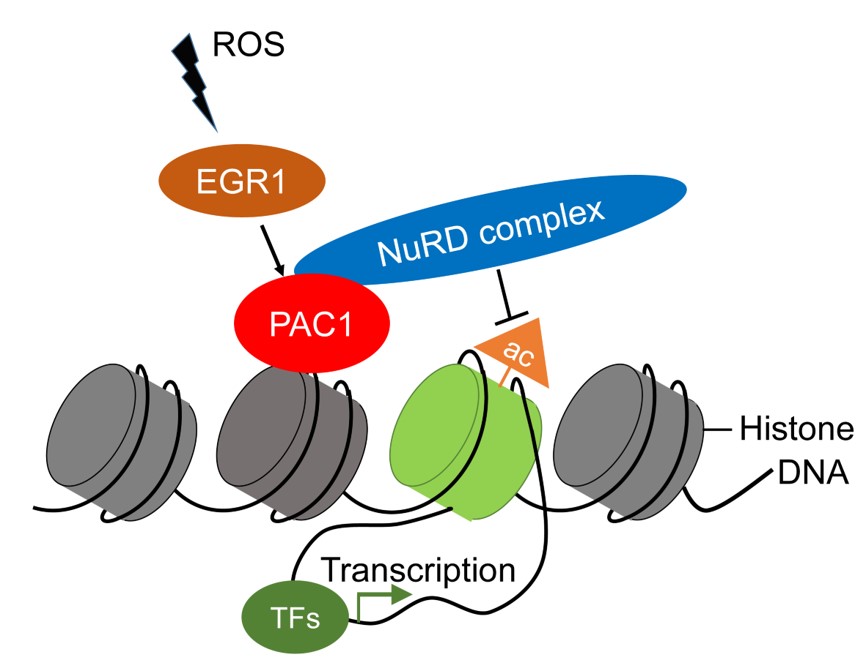
ROS-EGR1-PAC1信號通路參與誘導T淋巴細胞功能耗竭
作者簡介

尹玉新,意昂2平台講席教授,病理學教授,意昂2官网-清華生命科學聯合中心資深研究員。1997年畢業於美國北卡羅萊納大學,獲分子生物學和遺傳學博士學位。1999年加入美國哥倫比亞大學教授系列,2008至2018年任意昂2平台基礎醫學院院長,現任意昂2平台系統生物醫學研究所所長,中國病理生理學會系統生物醫學專業委員會主任委員。主要研究方向為腫瘤分子生物學與腫瘤免疫學🧛🏻♀️。2008年回國以來,主持了國家基礎研究重大項目(973計劃)👩🏻🦼➡️、國家重點研發計劃蛋白質機器與生命過程調控重點專項,國家自然科學基金重點項目☞、北京市自然科學基金重大項目等多項國家及部委級課題,取得了一系列重要成果。目前正深入研究腫瘤微環境和腫瘤發生發展機製,並開發新型腫瘤靶向和腫瘤免疫相關藥物,抑製腫瘤生長,改善腫瘤免疫治療。
(基礎醫學院)


